अध्याय 1
वैद्युत आवेश तथा क्षेत्र
प्रश्न 1: आवेश (charge)क्या है? इसके कितने प्रकार होते हैं?
उत्तर:
आवेश वह राशि है, जिससे किसी पदार्थ में विद्युत गुण उत्पन्न होते हैं।
आवेश के दो प्रकार होते हैं:
- धनावेश (Positive charge)
- ऋणावेश (Negative charge)
यह एक अदिश राशि है।
SI मात्रक: कूलॉम्ब (C)
आयामी सूत्र:
[M₀L₀T₁I₁]
NOTE: आवेश उत्पत्ति के लिए जिम्मेदार कारक इलेक्ट्रान होता अथवा इलेक्ट्रान सबसे छोटा कण है जिस पर आवेश होता है, जो परमाणु से वाहर निकल सकता है ।
प्रश्न 2: आवेश उत्पत्ति का इलेक्ट्रॉनीय सिद्धांत लिखिए।
उत्तर:
हम जानते हैं कि प्रत्येक पदार्थ परमाणुओं से मिलकर बना होता है। परमाणु के नाभिक में प्रोटॉन तथा न्यूट्रॉन होते हैं और नाभिक के बाहर इलेक्ट्रॉन परिक्रमा करते हैं।
परमाणु की सबसे बाहरी कक्षा (outermost shell) में उपस्थित इलेक्ट्रॉनों को संयोजक इलेक्ट्रॉन (Valence electrons) कहते हैं।
ये इलेक्ट्रॉन नाभिक के आकर्षण बल से कम बंधे होते हैं, इसलिए वे थोड़ी सी मात्रा में बाह्य उर्जा पाकर आसानी से बाहर निकल सकते हैं।
जब ये इलेक्ट्रॉन किसी वस्तु से बाहर निकलते हैं, तब वस्तु आवेशित हो जाती है।
👉 यही सिद्धांत आवेश उत्पत्ति का इलेक्ट्रॉनीय सिद्धांत कहलाता है।
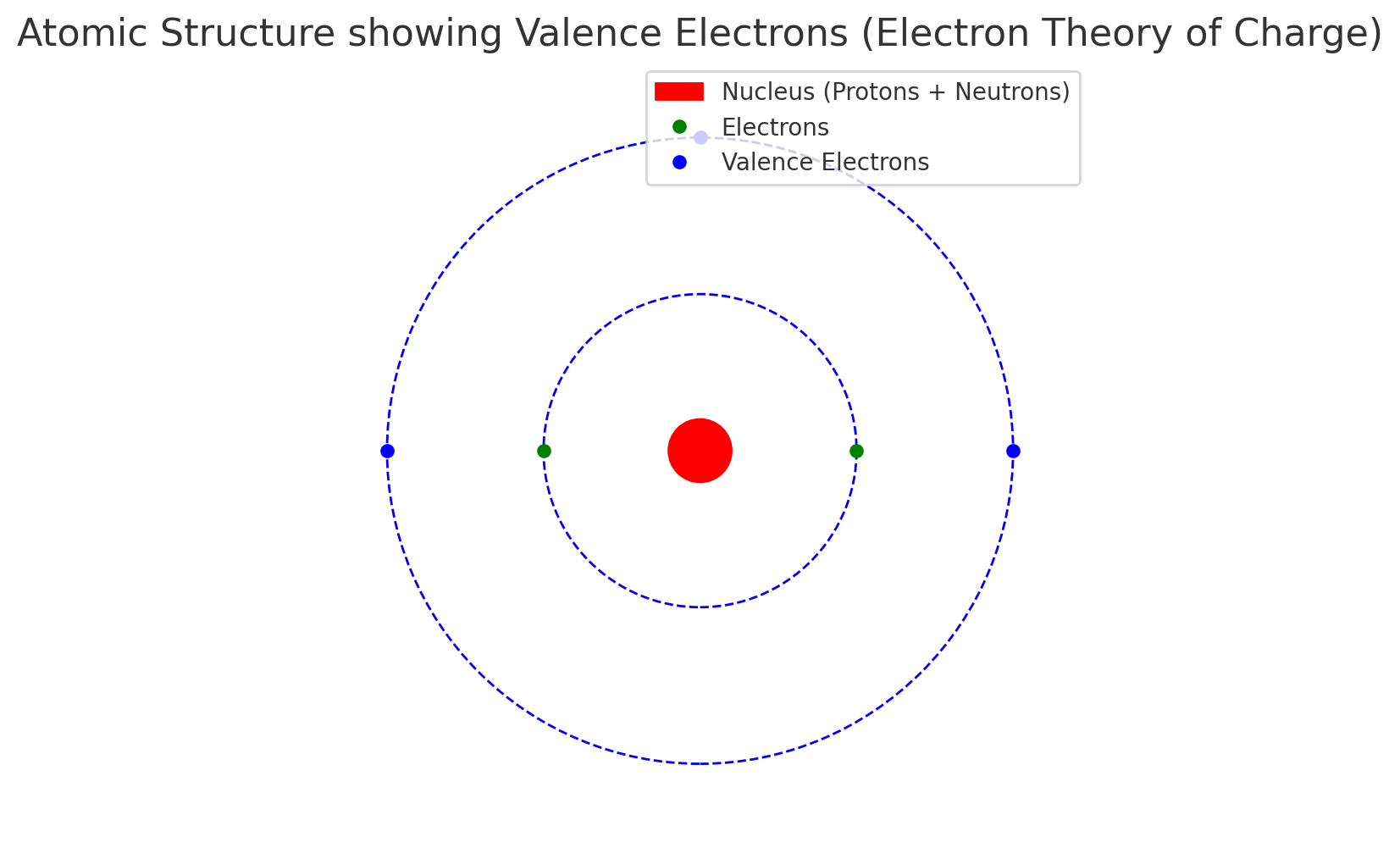
🔴 बीच का लाल गोला = नाभिक (प्रोटॉन + न्यूट्रॉन)
🟢 हरे बिंदु = इलेक्ट्रॉन (भीतरी कक्षा में)
🔵 नीले बिंदु = संयोजक (Valence) इलेक्ट्रॉन, जो आसानी से बाहर निकल सकते हैं
प्रश्न.3) घर्षण विद्युत (Frictional Electricity) क्या है?
जब दो भिन्न पदार्थों को आपस में रगड़ा जाता है तो इलेक्ट्रॉनों का स्थानांतरण होता है।
एक वस्तु पर धन आवेश (Positive Charge) और दूसरी पर ऋण आवेश (Negative Charge) आ जाता है।
इस प्रकार उत्पन्न हुई विद्युत को ही घर्षण विद्युत कहते हैं।
उदाहरण:
- कंघी को बालों में रगड़ने पर कंघी छोटे-छोटे कागज़ के टुकड़ों को आकर्षित करने लगती है।
- रबर की छड़ी को रेशम से रगड़ने पर वह आवेशित हो जाती है।
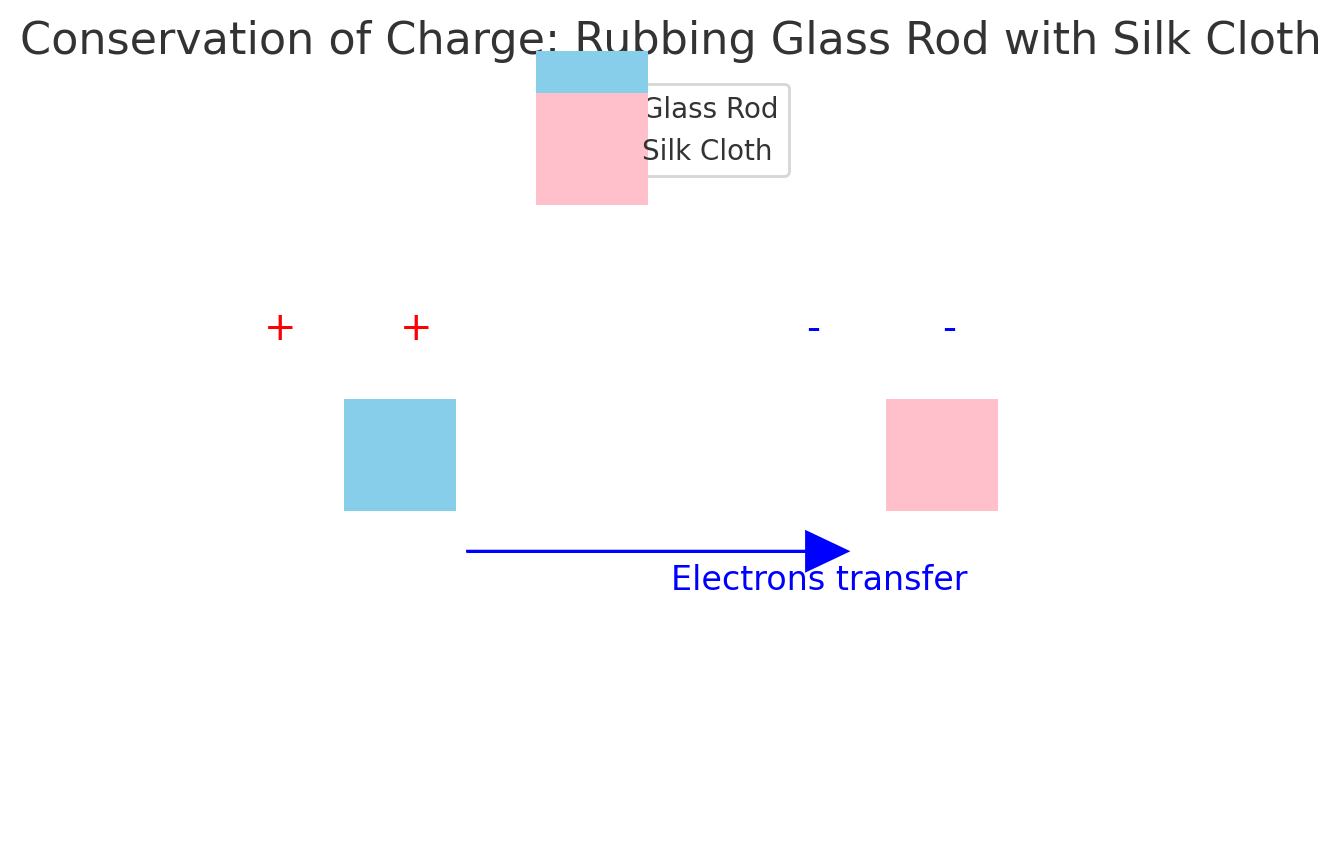
प्रश्न.4)आवेश का संरक्षण (Law of Conservation of Charge) क्या है ?
नियम:
कुल विद्युत आवेश न तो उत्पन्न होता है और न ही नष्ट होता है, यह केवल एक वस्तु से दूसरी वस्तु में स्थानांतरित हो सकता है।
उदाहरण:
जब दो वस्तुओं (जैसे रेशम और काँच) को रगड़ा जाता है, तो एक पर उतना ही धनावेश (Positive charge) उत्पन्न होता है जितना दूसरी पर ऋणावेश (Negative charge)।
👉 इस प्रकार कुल आवेश शून्य (0) ही रहता है।
Q5.) आवेश का क्वांटीकरण (Quantisation of Charge) क्या है ?
परिभाषा:
प्रकृति में किसी भी वस्तु पर आवेश का मान हमेशा एक निश्चित न्यूनतम आवेश का पूर्ण गुणज होता है।
इसे ही आवेश का क्वांटीकरण कहते हैं।
गणितीय रूप:
q = n × e
जहाँ,
- q = कुल आवेश
- n=±1,±2,±3,... (पूर्णांक)
- e=1.6×10-19 C (मूल आवेश – charge of one electron/proton)
● ● ● ● ●
e e e e e
कुल आवेश (q) = n × e
👉 यहाँ छोटे-छोटे गोले (●) इलेक्ट्रॉनों को दिखाते हैं।
👉 हर गोले का आवेश e है।
👉 जब n इलेक्ट्रॉन होंगे, तो कुल आवेश q=ne होगा।