अध्याय-1
रासायनिक अभिक्रियाए एवं समीकरण
We offer a 30-day return policy for all products. Items must be in their original condition, unused, and include the receipt or proof of purchase. Refunds are processed within 5-7 business days of receiving the returned item.
Q.1) रासयनिक अभिकिया क्या है?
Ans) रासयनिक अभिक्रिया एक ऐसी प्रक्रिया है, जिसमे एक या एक से अधिक पदार्थ मिलकर
या बदलकर एक या एक से अधिक नए पदार्थ बनाते है|
2H2 + 02 ---> 2H20
Q.2)अभिकारक एवं उत्पाद क्या है?
Ans)अभिकारक :- ऐसे पदार्थ जो रासयनिक अभिक्रिया मे भाग लेते है, अभिकारक कहलाते है |
उत्पाद:-अभिकिया के परिणाम स्वरूप जो हमे नया पदार्थ मिलता है उसे उत्पाद कहते है।
C + O2 ---> CO2 (कार्बन + ऑक्सीजन → कार्बन डाइऑक्साइड)
↑ ↑
अभिकारक उत्पाद
Q.3 ) रासायनिक अभिक्रिया की विशेषताए लिखिए?
Ans) रासायनिक अभिक्रिया की विषेशताए-
- गैस का निकलना
- अवक्षेप का तनन
- रंग मे परिवर्तन
- ताप मे वरिर्तन
- अवस्था में परिवर्तन
Note :-
अभिकिया मे विभिन्न अवस्थाएँ
Δ --->ऊष्मा, सूर्य का प्रकाश, दाव, ताप,
↑---> गैस का निकलना
उत्प्रेरक :- एसे पदार्थ जो अभिक्रिया मे भाग लिए विना अभिक्रिया की दर तीव्र या तेज कर देते है उत्प्रेरक
कहलाते है|
इसे तीर के निसान पर X द्वारा दिखाते है |
अवस्थाएँ :-
गैसीयरुप ---> (g)
ठोस रूप ---> (s)
द्रव रूप ---> (l)
तरल ठोस ---> (aq)
उदाहरण ;-
- Zn + H₂SO₄ → ZnSO₄ + H₂↑
- 2HCl(aq) + CaCO₃(aq) → CaCl₂(aq) + CO₂(↑) + H₂O(l)
Q.4) रासायनिक समीकरण क्या है इसको लिखने के नियम वताइए?
Ans) रासयनिक समीकरण :- रासायनिक अभिक्रिया के अभिकारकों एवं उत्पादों का उनके प्रतीक एवं सूत्र के रूप मे लिखना रासायनिक समीकरण कहलाता है।
उदहारण :
(कार्बन + ऑक्सीजन → कार्बन डाइऑक्साइड)
C + O2 → CO2
- रासायनिक समी. लिखने के नियम :-
- अभिक्रिया मे अभिकारक हमेशा वाएँ तरक लिखे जाएगे।
- यदि एक से अधिक अभिकारक है तो उनके बीच घन (+) चिन्ह होगा।
- अभिक्रिया में उत्पाद हमेशा दायें तरक लिखे जाएगे।
- यदि एक से अधिक उत्पाद है तो उनके बीच धन (+) चिन्ह आएगा।
- अभिकारक एवं उत्पादो के बीच तीर(--->)का निशान होता है जो अभिकिया की दिशा बताता है।
A+B ---> C+D
अभिकारक उत्पाद
Q.5) द्रव्यमान संरक्षण का नियम क्या है?
Ans) द्रव्य को न तो उत्पन्न किया जा सकता है और न ही नष्ट किया जा सकता है, रसायनिक अभिकिया मे अभिकारकों का संपूर्ण द्रव्यमान उनके उत्पादों उपस्थित रहता है। यही द्रव्यमान संरक्षण का नियम है।
Q.6) संतुलित रासायनिक समीकरण क्या है? समीकरण संतुलित करने के लिए नियम लिखिए ?
Ans) जिस रासायनिक अभिकिया मे इसके अभिकारकों एवं उत्पादो मे उपस्थित पदार्थों मे परमाणुओं की संख्या बराबर होती है संतुलित रसायनिक समीकरण कहते है।
उदहारण: 9H2 +O2 ---> 2H2O
रासयनिक समी को संतुलित करने के नियम:
- समीकरण को संतुलित करने के लिए समीकरण मे उपस्थित तत्व या यौगिक के सूत्र को नही बदलना चहिए।
- अभिकारक एवं उत्पादों के परमाणुभो की संख्या को अलग अलग गिनते हैं
- हम किसी भी प्रतीक या सूत्र को केवल अंक जैसे 2, 3,4,... आदि से गुणा कर सकते है
- यदि परमाणु की संख्या असमान है तो उस तत्ब या पदार्थ मे र्गुणांक (2,3,4,...) से गुणा करेगे।
- यह क्रिया तब तक करेगे जब तक दोनो तरक परमाणुओं की संख्या समान नही हो जाती।

Q.7) वायु में जलने से पहले मैग्नीशियम रिबन को साफ क्यों किया जाता है?
Ans: मैग्नीशियम रिबन को जलाने से पहले उसकी सतह से मैग्नीशियम आक्साइड की परत को हटाने के लिये साफ किया जाता है
Q.8) रासायनिक समीकरण लिखिए :
हाइड्रोजन + क्लोरीन → हाइड्रोजन क्लोराइड
H₂ + Cl₂ → 2HCl
बेरियम क्लोराइड + एल्युमिनियम सल्फेट → बेरियम सल्फेट + एल्युमिनियम क्लोराइड
3 BaCl₂ (aq) + Al₂(SO₄)₃ (aq) → 3BaSO₄ (s) + 2AlCl₃ (aq)
सोडियम + जल → सोडियम हाइड्रॉक्साइड + हाइड्रोजन
2Na(s) + 2H₂O(l) → 2NaOH(aq) + H₂(g)
Q.9) निन्मलिखित अभिक्रियाओं के लिए उनकी अवस्था संकेतों साथ संतुलित रासायनिक समीकरण लिखिए?
1.) जल में बेरियम क्लोराइड तथा सोडियम सल्फेट के विलयन आपस में अभिक्रिया करके सोडियम सल्फेट तथा बेरियम सल्फेट का अवक्षेप बनाते हैं।
BaCl₂(aq) + Na₂SO₄(aq) → BaSO₄(s) + 2NaCl(aq)
2.) सोडियम हाइड्रॉक्साइड का विलयन हाइड्रोक्लोरिक अम्ल के विलयन से अभिक्रिया करके सोडियम क्लोराइड का विलयन बनाता है।
NaOH (base) + HCl (acid) → NaCl (salt) + H₂O (water)
Q.10) रासायनिक अभिक्रियाओं के प्रकार समझाइए।
i) संयोजन अभिक्रिया :
ऐसी अभिक्रिया जिसमें दो या दो से अधिक अभिकारक मिलकर एकल उत्पाद का निर्माण करते हैं।
सयोजन अभिक्रिया कहते हैं|
A + B → C
उदाहरण:
- C + O₂ → CO₂
- CaO + H₂O → Ca(OH)₂
II) वियोजन अभिक्रिया :
जब एक अभिकारक टूटकर दो या दो से अधिक उत्पादों का निर्माण करता है, तो इसे वियोजन अभिक्रिया कहते हैं।
A ⟶ B + C
उदाहरण:
CaCO₃ (s) ⟶ CaO (s) + CO₂ (g)
2FeSO₄ (s) ⟶ Fe₂O₃ (s) + SO₂ (g) + SO₃ (g)
III) विस्थापन अभिक्रिया :
ऐसी अभिक्रिया जिसमें एक सक्रिय रासायनिक पदार्थ कम क्रियाशील पदार्थ को विस्थापित कर देता है,
विस्थापन अभिक्रिया कहलाती है।
A + BC → AB + C
उदाहरण :
Fe(s) + CuSO₄ (aq) ⟶ FeSO₄ (aq) + Cu(s)
Zn(s) + CuSO₄ (aq) ⟶ ZnSO₄ (aq) + Cu(s)
IV) द्विविस्थापन अभिक्रिया :
ऐसी अभिक्रिया जिसमें अभिकारकों के बीच आयनों का आपस में आदान-प्रदान होता है तथा नये उत्पाद प्राप्त होते हैं, द्विविस्थापन अभिक्रिया कहलाती है।
AB + CD ⟶ AD + CB
उदाहरण :
Na₂SO₄ (aq) + BaCl₂ (aq) ⟶ BaSO₄ (s) + 2NaCl (aq)
NaOH + HCl ⟶ NaCl + H₂O
MnO₂ + 4HCl ⟶ MnCl₂ + 2H₂O + Cl₂
Q.11) उष्माक्षेपी और उष्मासोषी अभिक्रिया की व्याख्या ?
उष्माक्षेपी:
ऐसी रासायनिक अभिक्रिया जिसमें ऊष्मा (heat) बाहर निकलती है (उत्सर्जित होती है), उसे उष्माक्षेपी अभिक्रिया कहते हैं।
लक्षण:
- तापमान बढ़ता है।
- अभिक्रिया के दौरान वातावरण गर्म हो सकता है।
- ऊर्जा उत्पाद के साथ बाहर निकलती है।
उदाहरण:
- CH₄ + 2O₂ ⟶ CO₂ + 2H₂O + ऊष्मा
- C + O₂ ⟶ CO₂ + ऊष्मा
-
उदासीनीकरण (Neutralization reaction):
HCl + NaOH ⟶ NaCl + H₂O + ऊष्मा - दहन अभिक्रियाएँ (Combustion reactions)
उष्मासोषी अभिक्रिया:
ऐसी रासायनिक अभिक्रिया जिसमें ऊष्मा को अवशोषित किया जाता है, उसे उष्मासोषी अभिक्रिया कहते हैं।
लक्षण:
- तापमान घटता है।
- अभिक्रिया के दौरान ठंडक महसूस हो सकती है।
- ऊर्जा को बाहरी स्रोत से लेना पड़ता है।
उदाहरण:
-
Photosynthesis (प्रकाश संश्लेषण):
6CO₂ + 6H₂O + ऊर्जा (सूर्य की) ⟶ C₆H₁₂O₆ + 6O₂ - Ba(OH)₂ + NH₄Cl ⟶ ठंडी अभिक्रिया (Temperature drops)
- N₂ + O₂ ⟶ 2NO (at high temperature)
-
Thermal decomposition reactions
CaCO₃ ⟶ CaO + CO₂ (ऊष्मा लेकर होती है)
Q.12) ऑक्सीकरण (उपचयन) एवं अपचयन की व्याख्या कीजिये ?
उपचयन (Oxidation):
ऑक्सीजन का जुड़ना या इलेक्ट्रॉन में कमी होना उपचयन कहलाता है।
उदाहरण:
2Cu + O₂ ⟶(Δ)⟶ 2CuO
(यहाँ ऑक्सीजन जुड़ रही है)
अपचयन (Reduction):
इलेक्ट्रॉन का जुड़ना या ऑक्सीजन में कमी होना अपचयन कहलाता है।
उदाहरण:
CuO + H₂ ⟶ Cu + H₂O
(यहाँ से ऑक्सीजन हट रही है)
Q.13) उपचयन - अपचयन या रेडॉक्स अभिक्रिया क्या है?
परिभाषा: ऐसी अभिक्रिया जिसमें एक ही समय पर उपचयन (Oxidation) एवं अपचयन (Reduction) दोनों क्रियाएँ होती हैं, उसे रेडॉक्स अभिक्रिया कहा जाता है।
उदाहरण 1:
ZnO + C ⟶ Zn + CO
- ZnO से Zn बनने में ऑक्सीजन हट रही है → अपचयन (Reduction)
- C से CO बनने में ऑक्सीजन जुड़ रही है → उपचयन (Oxidation)
उदाहरण 2:
MnO₂ + 4HCl ⟶ MnCl₂ + 2H₂O + Cl₂
- MnO₂ से MnCl₂ बन रहा है → अपचयन (Reduction)
- HCl से Cl₂ बन रहा है → उपचयन (Oxidation)
इस प्रकार की अभिक्रिया जिसमें एक तत्व ऑक्सीकरण और दूसरा अपचयन करता है, उसे Redox Reaction (रेडॉक्स अभिक्रिया) कहा जाता है।
Q.14) संक्षारण क्या है? इसको रोकने के उपाय लिखिए।
उत्तर:
संक्षारण :
जब कोई धातु वायु, नमी, जलवाष्प, अम्लीय वाष्प आदि के संपर्क में आती है, तो धीरे-धीरे नष्ट होने लगती है। इस क्रिया को संक्षारण कहते हैं।
धातुओं के वायुमंडलीय क्रियाओं से प्रभावित होकर नष्ट होने की प्रक्रिया को संक्षारण कहते हैं।
उदाहरण:
-
चाँदी के ऊपर काली परत चढ़ जाती है।
रासायनिक अभिक्रिया:
Ag + H₂O + O₂ ⟶ Ag₂O (OH)₂ -
लोहा में जंग लगना:
4Fe + 3O₂ + xH₂O⟶ 2Fe₂O₃•xH₂O (जंग)
संक्षारण को रोकने के उपाय:
- धातु के ऊपर पेंट या ग्रीस लगाना
- धातु के ऊपर तेल या जिंक (Zn) की परत चढ़ाना
- मिक्चर धातु बनाना
Q.15)विकृतगंधिता क्या है? इसको रोकने के उपाय लिखिए।
परिभाषा: जब कोई वसायुक्त (जैसे तेल, घी आदि युक्त) खाद्य पदार्थ बार-बार गर्म करने पर या लंबे समय तक खुली हवा में रखने पर उसमें दुर्गंध (बदबू) आने लगती है, तो उस स्थिति को विकृतगंधिता कहा जाता है। यह दुर्गंध रासायनिक विघटन, ऑक्सीकरण, या सूक्ष्मजीवों के प्रभाव के कारण उत्पन्न होती है।
उदा. पैकेट बंद चिप्स को बाहर रखने पर खराब होना।
रोकने के उपाय:
- खाद्य पदार्थों में प्रतिऑक्सीकारक (Antioxidants) मिलाए जाते हैं।
- पैकेट बंद खाद्य पदार्थों को वैक्यूम पैकिंग या नाइट्रोजन गैस में पैक किया जाता है।
- ठंडी और सूखी जगह पर खाद्य वस्तुओं को रखा जाता है।
Q.16) किसी पदार्थ 'X' के विलयन का उपयोग सफ़ेदी (bleaching) करने के लिए होता है।
(i) पदार्थ 'X' का नाम तथा इसका सूत्र लिखिए ?
ANS)
नाम: बुझा हुआ चुना
रासायनिक सूत्र: CaO
(कैल्शियम ऑक्सीक्लोराइड)
(ii) ब्लीचिंग पाउडर की जल के साथ अभिक्रिया लिखिए ?
अभिक्रिया:
CaO+H2O→Ca(OH)2(aq)
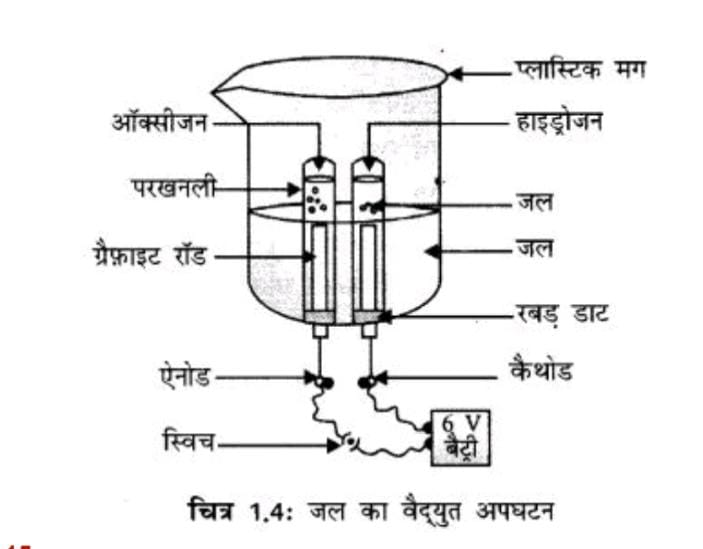
Q.17) क्रियाकलाप में एक परखनली में एकत्रित गैस की मात्रा दूसरी से दोगुनी क्यों है? उस गैस का नाम बताइए।
हमें ज्ञात है कि जल (H₂O) में 2 भाग हाइड्रोजन और 1 भाग ऑक्सीजन परमाणु होते हैं।
जब जल का वैद्युत अपघटन (electrolysis) किया जाता है, तब:
- कैथोड (ऋणध्रुव) पर हाइड्रोजन गैस (H₂) निकलती है।
- एनोड (धनध्रुव) पर ऑक्सीजन गैस (O₂) निकलती है।
पानी का अणु दो हाइड्रोजन और एक ऑक्सीजन परमाणु से बना होता है, यानी:
2:1 का अनुपात।
इसलिए, हाइड्रोजन गैस की मात्रा ऑक्सीजन से दोगुनी होती है।
Q.18)जब लोहे की कील को कॉपर सल्फेट (CuSO₄) के विलयन में डाला जाता है, तो विलयन का रंग नीला क्यों बदल जाता है?
जब लोहे की कील को कॉपर सल्फेट (CuSO₄) के नीले रंग वाले विलयन में डाला जाता है, तो लोहा, कॉपर से अधिक क्रियाशील होता है। इसलिए, लोहा ताँबे को विस्थापित कर देता है और स्वयं लौह सल्फेट (FeSO₄) बना लेता है।
लौह सल्फेट का रंग हरा (हल्का हरा/फीका हरा) होता है। इसलिए विलयन का रंग नीले से हरा हो जाता है।
रासायनिक अभिक्रिया:
Fe(s)+CuSO4(aq)→FeSO4(aq)+Cu(s)
Q.19)निम्न अभिक्रियाओं में उपचयन तथा अपचयन पहचानिए।
ANS: (i)4Na(s)+O2(g)→2Na2O(s)
यह उपचयन (Oxidation) है।
कारण: सोडियम (Na) ने ऑक्सीजन से अभिक्रिया करके Na₂O बनाया, यानी ऑक्सीजन से जुड़ गया।
ऑक्सीजन से जुड़ना = उपचयन।
(ii)CuO+H2→Cu+H2O
इसमें CuO का अपचयन (Reduction) हुआ है — Cu में बदल गया।
और H₂ का उपचयन (Oxidation) हुआ है — H₂O बना।